服务热线400-928-2622
医疗器械唯一标识(UDI),并不是医疗器械行业近几年新诞生的要求,而在ISO 13485体系中本身就有可追溯性要求的要素,但从行业发展的观点看,UDI是全球性的医疗器械唯一标识系统,也是全球医疗器械市场国际化发展的必然趋势。本文从UDI的定义、UDI的范围和要求、UDI的重要性、UDI的扫描设备及实施UDI的困难与挑战,七个方面进行综述,供医疗器械从业人员的爱好者学习,借鉴。
Unique device identification (UDI) 是美国食品药物管理局FDA建立的”特殊医疗器械的识别系统”,该注册码的实施是为了有效识别在美国市场上销售并使用的医疗器械,无论其生产地在哪里。一旦实施,NHRIC和NDC标签将废止,所有的医疗器械都需要将这个新的注册码作为标识贴在产品的外包装上。除了满足可见(visible)之外,UDI必须满足纯文本形式和自动识别技术(automatic identification and data capture, AIDC). 器械的标签负责人员也必须将每个产品的确实信息发送到“FDA国际特殊医疗器械识别库UDID”内,使公众可以通过访问该数据库查询并下载相关数据(包括从生产,分销到客户使用情况的信息等),但该数据库不会提供器械使用者的信息。
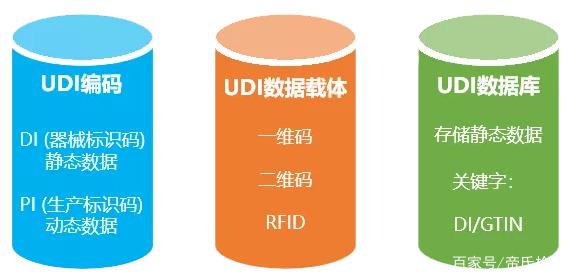
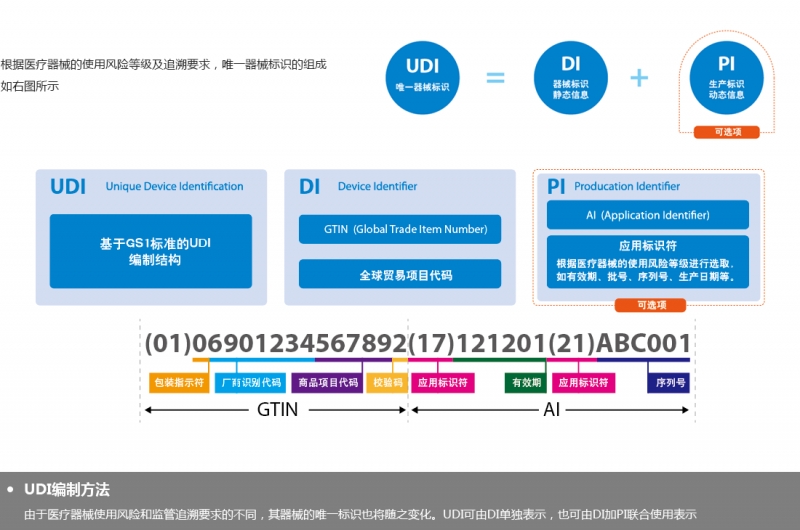
主要是一个由数字或字母组成的编码。由器械识别码(DI)和生产识别码(PI)组成。
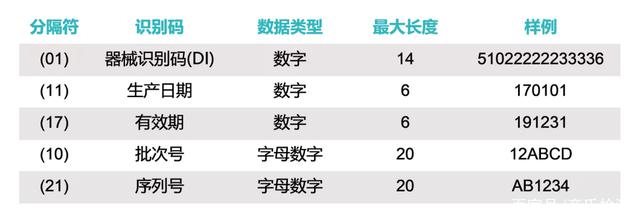
器械识别码是强制固定的编码,包含了标签管理人员的信息、设备特定版本或型号,而产品识别码不受特别规定,包含了器械生产批号、序列号、生产日期、失效日期以及作为器械管理的生命细胞组织产品的特有识别码。
其次说说GUDID,Global Unique Device Identification System (GUDID), FDA国际特殊医疗器械识别库。数据库通过AccessGUDID查询系统对外公开。不但可以直接在数据库网页输入标签信息中的UDI的DI码找到产品信息, 还可以通过任一医疗器械的属性搜索(例如仪器识别码Device identifier, 公司或商品名称,通用名称或者器械的型号、版本),但值得注意的是,该数据库不提供器械的PI码。
即UDI定义:唯一器械标识(Unique Device Identification,缩写UDI)是对医疗器械在其整个生命周期赋予的身份标识,是其在产品供应链中的唯一“身份证”。全球采用统一的、标准的UDI有利于提高供应链透明度和运作效率;有利于降低运营成本;有利于实现信息共享与交换;有利于不良事件的监控和问题产品召回,提高医疗服务质量,保障患者安全。
1、器械识别码:
• 器械的版本号或型号 •器械贴标者(使标签置于器械上、使标签修改、或者使器械引入商业的人)
2、生产识别码:
(1)例如批号或批次、序列号、到期日期、生产日期;对于被作为医疗器械监管的人体细胞、组织、或细胞和组织产品,要求使用特定的识别码。除了特定的器械识别码,还需要将有关器械的信息输入到GUDID,其中包括器械识别码,以及下列内容的每一项。生产识别码是不需要的;
(2)如果器械使用直接标识, 并且直接标识与器械标签上的标识不一致,需要说明哪一个为器械识别码;
(3)之前的器械识别码(如果贴标器械为新版本或新型号);
(4)器械版本或型号;
(5)标签上的生产识别码的类型;
(6)FDA市场准入的类型及编号,和列名编号;
(7)基于“全球医疗器械命名系统(GMDN)”的产品代码;
(8) FDA产品代码;
(9)每个包装内的单个器械的数量。
FDA在发布UDI法规提案时,确定了几个目标。
1.减少医疗差错;
2.简化将器械使用信息集成到数据系统的操作;
3.更加迅速地识别出现不良事件的医疗器械;
4.更加迅速地为已报告的问题制定解决方案;
5.提供更加迅速、更有效的器械召回解决方案;
6.实现更加重点突出且有效的FDA安全沟通;
7.轻松访问明确器械标识信息的原始来源。
根据UDI最终法规, UDI将会大大减少对美国市场中的医疗器械进行充分识别的障碍。因为UDI可以迅速并明确地识别出器械安全和有效性的关键属性,所以UDI的出现会大大减少此类医疗差错。这是因为这些差错可能是由于器械标识不当或有关其恰当使用的困惑而引起。
UDI系统的优势将会逐步在医疗分配系统中体现出来。各大医疗器械体系在推广UDI的介绍词中都包括了安全性,可追踪性,高效性。
该UDI系统能够提高用户的安全、新型医疗器械售后监管和帮助医疗器械的革新。考虑到使用者的安全,当UDI系统完备后,有质量风险的医疗器械将会更容易被追踪和监控,对于不良事件的反馈可以更加有效,审查和分析更加准确,有助于使用者最快时间内解决安全隐患,同时也便于医疗保险的清算。一旦假冒伪劣产品流入市场,查询GUDID数据库关于销售网络的情况,便于使用者判断产品真伪。
UDI系统的出台,另一方面也促进了生产企业的转型,对于产品召回和安全隐患带来的利益损失,督促企业完善质量管理体系,保证产品的有效和安全。
UDI识别码正逐步在世界范围内被接纳,作为提高不良反应事件的报告质量,明确医患纠纷和管理医疗器械分销网络的利器,尽管对于医疗器械生产商来说投入颇大,但不可忽视的是,其对于病人安全的重要保护和医疗器械国际化的监管优化。
1.费用庞大。根据EUcomed 关于2020年前企业UDI建立所耗费的资金调研,整个产业估计耗费涉及10亿欧元。
2. 关于UDI的法规不完善。我国的UDI编码方案正在开展。
3. 思想的转变。很多医院只是满足内部需求,在编码上没有采用统一标准的意识。很多企业和医疗行业未认识到医疗器械追溯和维修,这样一整个完整体系建立的必要性。
4、公司应积极应对,研究各目标市场,及早准备。
对公司而言,尽早制定出符合新UDI要求的策略至关重要。该策略需要包括如何识别所有产品的版本和型号、适用的分类、适用的现行标识方案,并且要对需要根据法规及时进行为满足正确贴标而准备的内容进行差距分析。还必须确定公司将使用的条形码技术、公司将会需要聘用的经FDA批准的号码颁发机构、准备创建将在GUDID中记录信息所需的账户、以及如何获取合适的用于填充GUDID的资源。同时,公司可能需要确定符合标签规定的标签软件程序包,并根据合规日期要求,公司为产品设计和实施新标签所需的资源。